Kako baterija proizvodi elektricitet mijenjanjem kemijske energije u električnu
Tagovi:

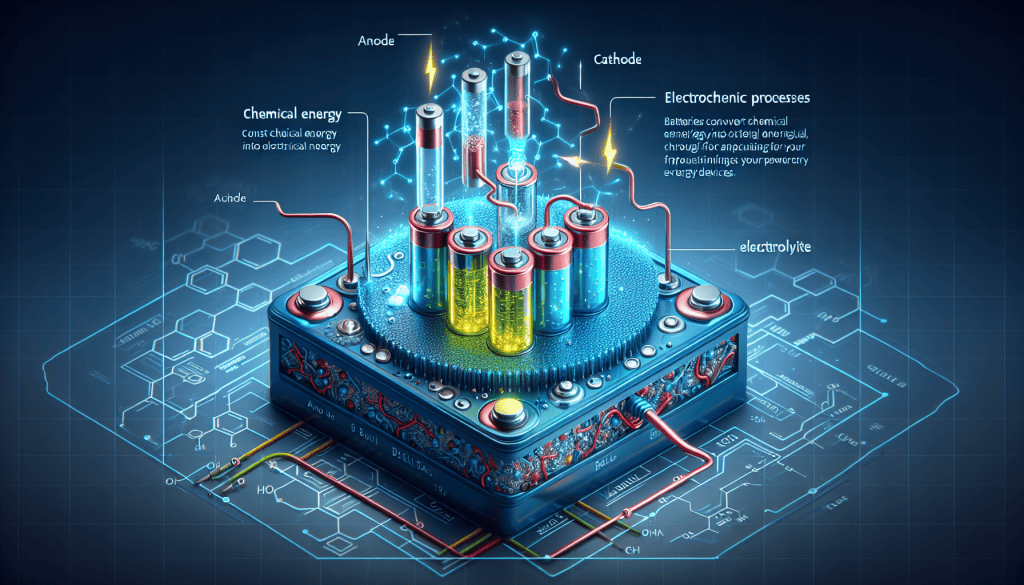
Akumulator, poznat i kao baterija, uređaj je koji skladišti električnu energiju u kemijskom obliku i pretvara je u električnu energiju kada je to potrebno. Osnovni princip rada akumulatora temelji se
Skorim povratkom na zimsko računanje vremena dolazi do promjena kod obračuna električne energije za dnevnu te noćnu potrošnju. Navedeno znači da će se potrošena električna energija prema višoj tarifi
Od početka ovog mjeseca, Ministarstvo financija pod vodstvom ministra Marka Primorca najavilo je novi zakon kojim će se ukinuti naknade za vođenje osnovnih bankovnih računa. Banke su na ovu promjenu r
Ravnatelj KBC-a Zagreb, Ante Ćorušić, tragično je preminuo nakon pada s požarnih stepenica u bolnici. Zamjenik ravnatelja, Milivoj Novak, potvrdio je tužnu vijest o smrti svog kolege. Ministar zdravs
Vrijeme prolazi, a s njim dolazi i trenutak kada tradicionalno prelazimo na zimsko računanje vremena. Za mnoge to znači prilagodbu na kraće dane, ali i jedno važno pitanje: „Da li sat pomičemo naprije
Zagrebačka škola u Novom Zagrebu ponovno se našla u središtu pozornosti nakon što je učenik, zbog kojeg se početkom školske godine ispisao cijeli razred, izazvao nove probleme. Samo dan nakon što je p
